FDA認証の取り方
FDAの承認を得る方法は、米国で販売している製品の種類によって異なります。 FDAは、すべてのタイプの製品についてFDAの承認を要求していません。以下の説明を読んで、FDAの承認が必要な製品と、必要な場合にFDAの承認を取得する方法を確認してください。
食品、飲料、栄養補助食品のFDA承認
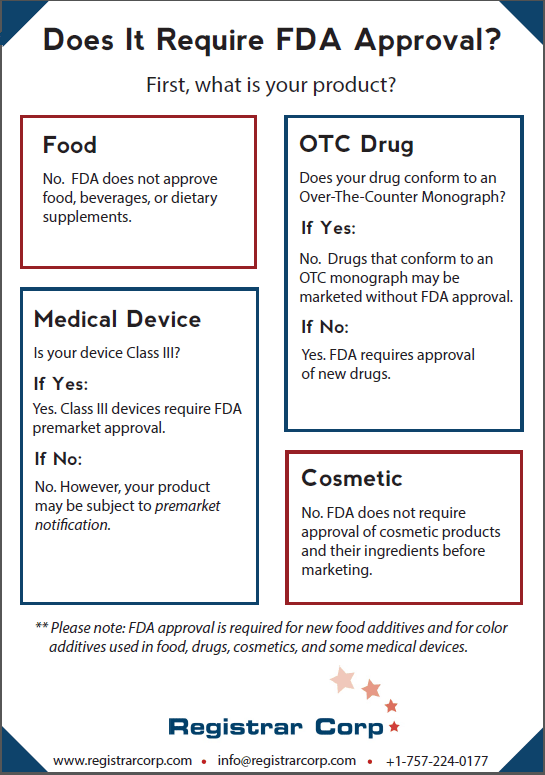
FDAは、食品、飲料、栄養補助食品を承認するわけではありません。食品業者は、米国で製品を流通させる前に、いかなる種類の認証または承認も取得する必要はありません。食品業者はFDAへの登録が必要ですが、FDAへの登録は、施設またはその製品をFDAが承認したことを示すものではありません。
新しい食品添加物にはFDAの承認が必要です。メーカーが自社の製品に新しい食品添加物を使用したい場合、その添加物を適切な試験にかけ、その添加物が安全であることをFDAに証明する必要があります。
FDAによる医薬品の承認
新薬がFDAの承認を必要とするかどうかは、新薬がOTC論文に準拠しているかどうかによって異なります。 OTC論文は、FDAが薬物が安全で効果的であるとする条件に照らし合わすものです。 OTC論文が完成したら、製薬会社は、FDAの承認なしに、論文に準拠するOTC医薬品を販売できます。 FDAはまた、施行の裁量を使用して、特定の医薬品が暫定的な最終論文に準拠している場合、承認なしで販売できるようにします。
新薬が論文に準拠していない場合、FDAの承認が必要になります。 FDAの承認を得るために、製薬会社はラボ、動物、およびヒトの臨床試験を実施し、そのデータをFDAに提出する必要があります。その後、FDAはデータを確認し、薬剤の利点が意図された使用のリスクを上回るとが判断した場合、は薬剤を承認する場合があります。 FDAの承認なしにOTC論文に準拠していない新薬を販売することは、承認されていない新薬を販売することと見なされます。これは、食品医薬品化粧品法(FD&C法)の下で禁止されている行為です。
FDAは新薬を承認しますが、配合薬の承認は別です。医薬品業者はFDAに登録してその製品をリストする必要がありますが、登録もリストも、FDAがその業者や製品の承認を示しているわけではありません。
医療機器のFDA承認
FDAは、医療機器をクラスI、クラスII、およびクラスIIIという3つのリスクベースのカテゴリーに分類します。クラスIIIデバイスは最もリスクの高いデバイスであり、FDAの市販前承認が必要な唯一のデバイスです。クラスIIIデバイスの製造業者は、デバイスが安全性と有効性の合理的な保証を提供することをFDAに示す必要があります。
クラスIおよびIIデバイスは、FDAの承認を必要としません。これらのデバイスは、FD&C法の下で免除されない限り、市販前通知(510(k))をFDAに提出する必要があります。 510(k)の目的は、デバイスが既に合法的に販売されているデバイスと(安全かつ効果的に)実質的に同等であることをFDAに示すことです。デバイスが実際に合法的に販売されているデバイスと実質的に同等であるとFDAが判断した場合、当局は製品を販売許可を出すのですが承認したことは示しません。
デバイスの施設は、FDAに登録してデバイスをリストする必要がありますが、登録もリストも、業者またはそのデバイスのFDA承認を示していません。
化粧品のFDA承認
FDAは、市販前に化粧品とその成分(着色添加剤以外)の承認を要求していません。化粧品会社はFDAに登録する必要はありませんが、化粧品は意図された使用法に対して安全でなければなりません。
化粧品のラベリングで行われた特定の主張により、FDAが化粧品を医薬品として規制する可能性があることを認識することが重要です。場合によっては、これにより製品にFDAの承認が必要になることがあります。
着色料のFDA承認
食品、医薬品、化粧品、一部の医療機器に使用される着色添加物には、FDAの承認が必要です。特定のリスクの高い色には、個々のバッチごとにFDAカラーバッチ認証も必要です。着色添加剤は、承認された使用法、仕様、および制限に従ってのみ使用できます。未承認の着色添加物を含む製品は、FD&C法の下で偽装されたと見なされます。
FDA承認製品のラベル付け
FDAの承認を必要とする薬物およびデバイスの製造元は、製造元がFDAから承認を確認する書簡を受け取っている限り、製品のラベルに「FDA承認」という語句を含めることができます。製品が承認されているかどうかに関係なく、FDAのロゴを製品のラベルに使用することは許されません。 FDAロゴの使用は、製品がFDAによって承認されていることを意味と受け取られるため、ロゴの不正使用は連邦法に違反する可能性があります。製品のラベルにFDAのロゴを使用している製造業者は、民事または刑事責任を問われる場合があります。
FDAの承認を必要とするかどうかにかかわらず、食品業者、製薬会社、機器会社、化粧品会社は、FDAの現在の適正製造基準(CGMP)と広範な表示要件を遵守する必要があります。承認が必要な製品については、特定の薬物やデバイスなどでは、製品が承認された時点でラベルが承認されます。 ただし、ラベルは一般にFDAの承認の対象ではありません。
ので、FDAがその要件をどのように強制力をもたせるのかと疑問に思われるかもしれません。 FDAは、米国国境での定期的な施設検査抜き打ち的に実施される出荷検査を通じてその要件を実施行しています。
レジストラ・コープは、食品、医薬品、医療機器、化粧品会社が米国FDA規制に準拠させるのを支援します。レジストラ・コープは、企業をFDAに登録し、その製品をFDAに一覧化して、製品ラベルのFDA基準への準拠を確認できます。 レジストラ・コープは、カラーバッチ認証のためにFDAに着色添加剤の提出も致します。
その他FDA規制承認の取得方法、またはRegistrar Corpのサービスの詳細については、+ 1-757-224-0177に問い合わせるか、www.registrarcorp.com / LiveHelpで24時間規制担当とチャットしてください。 。

