Comment obtenir l’approbation de la FDA ? (FDA approval)
Comment obtenir l’approbation FDA (FDA approval) dépend du type de produit que vous voulez vendre aux États-Unis. La FDA ne requiert pas l’approbation FDA pour tout type de produit. Regardez ci-dessous pour comprendre quels produits nécessitent l’approbation FDA et comment l’obtenir si nécessaire.
Approbation FDA des produits alimentaires, boissons, et compléments alimentaires
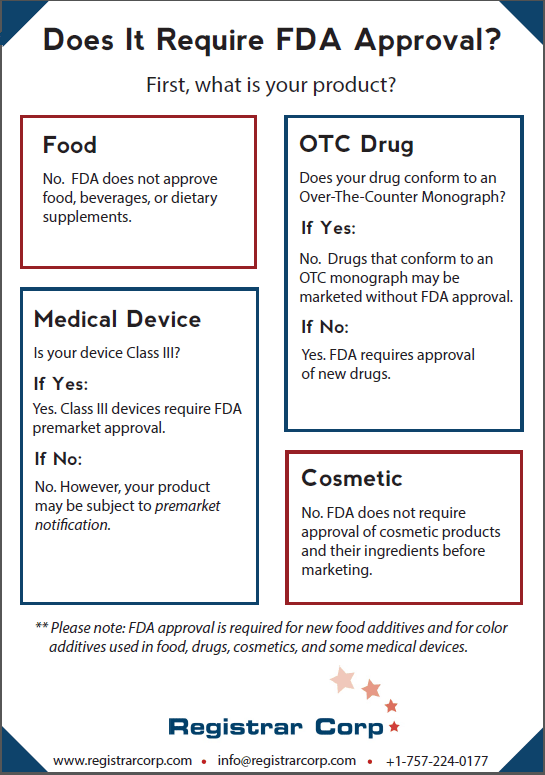
Il n’y a pas d’approbation FDA pour les produits alimentaires, boissons, et compléments alimentaires. Les établissements alimentaires n’ont à obtenir aucun type de certification ou approbation avant de distribuer leurs produits aux États-Unis. Les établissements alimentaires ont l’obligation de s’enregistrer avec l’U.S. FDA, mais être enregistré avec la FDA n’indique pas que votre établissement ou produit est approuvé par la FDA.
Seuls les nouveaux additifs alimentaires requièrent l’approbation FDA . Si un fabricant veut utiliser un nouvel additif alimentaire dans son produit, il devra soumettre l’additif à des tests appropriés et prouver à la FDA que l’additif n’est pas dangereux.
Approbation FDA des produits pharmaceutiques
Un nouveau produit pharmaceutique nécessite soit l’approbation FDA soit la conformité avec avec une monographie OTC. Les monographies OTC établissent des conditions sous lesquelles la FDA a pré-déterminé qu’un produit pharmaceutique en vente libre est sûr et efficace. Une fois qu’une monographie OTC est finalisée, les établissements pharmaceutiques peuvent mettre sur le marché les produits pharmaceutiques en vente libre qui se conforment aux monographies sans l’approbation FDA. La FDA utilise aussi son pouvoir de mise en application (enforcement discretion) pour permettre à certains produits pharmaceutiques d’être commercialisés sans approbation s’il se conforment aux projets de versions finales des monographies.
Si un nouveau produit pharmaceutique ne se conforme pas à une monographie, il nécessitera une approbation FDA. Pour obtenir une approbation FDA, les établissements pharmaceutiques doivent conduire des tests cliniques laboratoire, animal, et humain puis soumettre leurs données à la FDA. La FDA va ensuite vérifier les données et peut approuver le produit pharmaceutique si l’agence détermine que le bénéfice du produit pharmaceutique est supérieur à ses risques pour l’usage indiqué. Commercialiser un nouveau produit pharmaceutique qui ne se conforme pas à une monographie OTC sans l’approbation FDA est considéré comme commercialiser un produit pharmaceutique non-approuvé, ce qui est une action prohibée selon la loi Food, Drug, and Cosmetic Act (FD&C Act).
Bien que la FDA approuve des nouveaux produits pharmaceutiques, l’agence n’approuve pas les préparations médicamenteuses. Ces établissements pharmaceutiques doivent s’enregistrer avec la FDA et enregistrer leurs produits (listing), mais ni l’enregistrement de l’établissement ou des produits n’indiquent une approbation FDA de l’établissement ou des produits.
Approbation FDA des dispositifs médicaux
La FDA place les dispositifs médicaux dans l’une des trois catégories suivantes basées sur les risques : Class I, Class II, and Class III. Les dispositifs Classe III sont les dispositifs a plus haut risque et les seuls qui nécessitent une approbation FDA d’avant mise sur le marché. Les fabricants de dispositifs Classe III doivent démontrer à la FDA que le dispositif fournit des assurances raisonnables de sécurité et d’efficacité.
Les dispositifs Classe I et Classe II ne nécessitent pas l’approbation FDA. Ces dispositifs, sauf exception sous le FD&C Act, doivent à la place soumettre une notification préalable à la mise sur le marché (510(k)) à la FDA. Le but d’une notification 510(k) est de démontrer à la FDA que le dispositif est substantiellement équivalent (aussi sûr et efficace) qu’un dispositif déjà légalement commercialisé. Si la FDA détermine que le dispositif est en effet substantiellement équivalent à un dispositif déjà légalement commercialisé, l’agence autorise le produit à être commercialisé plutôt que de l’approuver.
Les établissements de dispositifs doivent s’enregistrer à la FDA et enregistrer leurs dispositifs (device listings), mais ni l’enregistrement de l’établissement ou des dispositifs n’indiquent une approbation FDA de l’établissement ou des dispositifs.
Approbation FDA des cosmétiques
La FDA n’exige pas l’approbation des produits cosmétiques et de leurs ingrédients (autres que colorants) avant la commercialisation. Les entreprises cosmétiques n’ont pas l’obligation de s’enregistrer avec la FDA mais les produits cosmétiques doivent être sûrs pour leur usage prévu.
Il est important d’être prévenu que certaines allégations faites sur des étiquetages cosmétiques peuvent induire le produit cosmétique à être considéré par la FDA comme un produit pharmaceutique. Dans certains cas, cela peut créer la nécessité d’obtenir une approbation de la FDA.
Approbation FDA des colorants
L’approbation FDA est requise pour les colorants utilisés dans les produits alimentaires, pharmaceutiques, cosmétiques et certains dispositifs médicaux. Certaines couleurs à haut risques nécessitent aussi la certification de lot de colorant FDA pour chaque lot fabriqué. Les colorants peuvent être employés seulement en conformité avec leurs usages, spécifications, et restrictions approuvés. Les produits qui contiennent des colorants non-approuvés sont considérés comme adultérés selon le FD&C Act.
Étiquetage des produits approuvés par la FDA
Les fabricants de produits pharmaceutiques et dispositifs médicaux qui nécessitent une approbation FDA peuvent inclure la phrase “FDA Approved” sur l’étiquetage du produit, à condition que le fabricant ait reçu une lettre de la FDA confirmant son approbation. Le logo FDA ne doit pas être utilisé sur un étiquetage de produit qu’il soit approuvé ou non. L’usage du logo FDA pourrait suggérer que le produit est conseillé par la FDA, c’est pourquoi un usage non autorisé de ce logo pourrait violer certaines lois fédérales. Les fabricants qui utilisent le logo FDA sur leurs étiquetage de produits peuvent être sujets à des poursuites pénales ou civiles.
Qu’un produit nécessite ou pas l’approbation FDA, les établissements alimentaires, pharmaceutiques, de dispositifs médicaux, et de produits cosmétiques doivent se conformer aux règlementations FDA Current Good Manufacturing Practices (CGMPs) et à des exigences complexes en matière d’étiquetage. Pour les produits qui nécessitent l’approbation, comme certains produits pharmaceutiques ou dispositifs, l’étiquetage est approuvé quand le produit l’est. Toutefois les étiquetages ne sont généralement pas sujets à l’approbation par la FDA.
Vous vous demandez peut être comment la FDA fait respecter ses exigences quand autant de produits ne nécessitent pas d’approbation de pré-commercialisation. La FDA fait respecter ses exigences avec des inspections de routine des établissements et des inspections aléatoires a la frontière U.S..
Registrar Corp aide les entreprises alimentaires, pharmaceutiques, cosmétiques et de dispositifs médicaux à satisfaire les règlementations U.S. FDA. Registrar Corp peut enregistrer une entreprise et ses produits (listing) avec l’U.S. FDA, et vérifier ses étiquetages de produits pour la conformité FDA. Registrar Corp peut aussi aider à soumettre des colorants à la certification FDA de lot de colorant.
Pour des questions additionnelles à propos de comment obtenir l’approbation FDA et concernant les autres règlementations FDA, ou pour en apprendre plus sur les services de Registrar Corp, contactez le +1-757-224-0177 ou chattez avec un conseiller règlementaire 24h/24h sur regstaging.wpengine.com/LiveHelp.

